Исмаилова Наталья Супьяновна к.м.н., врач-косметолог, член Американской академии эстетической медицины, сертифицированный тренер компании Ipsen, научный руководитель ГК «МЕЛИС», главный врач клиники «МЕЛИС», Москва.
Как известно, гиалуроновая кислота (ГК) является важным компонентом нашей кожи, обеспечивающим необходимую для нормального функционирования гидратацию и структуру дермального матрикса. Инъекции гиалуроновой кислоты являются одними из самых популярных процедур в эстетической медицине, давно подтвердившими свою безопасность и эффективность. Можно ожидать, что экзогенная ГК не только компенсирует недостаточность влаги и обеспечит эстетическую коррекцию, но и окажет стимулирующий эффект для активации синтеза нативной ГК. При этом хорошо известно, что в зависимости от своего молекулярного веса гиалуроновая кислота может оказывать различные эффекты на клетки и ткани.
Размер имеет значение
Долгие годы мы старались отдавать предпочтение высокомолекулярной гиалуроновой кислоте, которая лежит в основе классических схем биоревитализации. При этом важно признать, что вопреки распространенному мнению ревитализирующим свойством обладает не только высокомолекулярная гиалуроновая кислота. В последнее время все чаще появляются гибридные препараты, в которых помимо высокомолекулярной ГК присутствует и низкомолекулярная ГК. Результаты исследований подтверждают, что при применении низко- и среднемолекулярной ГК (в отличие от высокомолекулярной) у пациентов с признаками возрастной атрофии наблюдалось увеличение содержания коллагена и эластических волокон в поверхностных слоях дермы, усиление васкуляризации, а также увеличение толщины кожи на участках атрофии.
Возможно, пора задуматься о том, что высокомолекулярная гиалуроновая кислота не оказывает прямого стимулирующего влияния. В процессе деградации этой молекулы под действием металлопротеиназ происходит укорочение ее цепей с образованием более коротких фрагментов, которые обладают способностью стимулировать фибробласты. Синтез гиалуроновой кислоты регулируется механизмом ауторегуляции по принципу обратной связи. Высокая концентрация ГК во внеклеточном пространстве, например, в период пролиферации и на первых фазах регенерации тканей, частично ограничивает формирование элементов внеклеточного матрикса, в частности коллагена. Более того, в концентрации 1 мг/мл гиалуроновая кислота активизирует некоторые виды металлопротеиназ, присутствующих в матриксе. Для возникновения стимулирующего эффекта гиалуроновой кислоты необходима ее частичная деградация до средне- и низкомолекулярных фрагментов. Низкомолекулярная гиалуроновая кислота, наоборот, ингибирует экспрессию матричных металлопротеиназ, уменьшая их коллагендеградирующее действие, а также стимулирует ангиогенез, деление и миграцию клеток.
В ряде исследований было доказано, что небольшие концентрации экзогенной гиалуронидазы способны увеличивать количество гиалуроновой кислоты за счет расщепления вновь синтезированных цепей по мере их выдавливания через пороподобные структуры из клетки во внеклеточное пространство. Образовавшиеся короткие фрагменты служат для фибробластов сигналом о недостатке ГК в тканях, что, в свою очередь, индуцирует дополнительный синтез нативной ГК. Присутствие низкомолекулярной ГК всегда будет способствовать обновлению дермального матрикса и его омоложению. В частности, было выявлено, что в коже возрастных крыс содержится высокий процент высокомолекулярной ГК, что отражает неспособность стареющих тканей генерировать фрагменты с более низким молекулярным весом и приводит к снижению их регенеративного потенциала. Учеными установлено, что низкомолекулярные фрагменты ГК, состоящие из 20–38 дисахаридов, имеют максимальное сродство к рецепторам CD44 на поверхности фибробластов. Они прикрепляются к рецепторам бивалентным путем и создают оптимальное периклеточное гидрофильное окружение.
Таким образом, препараты, содержащие олигосахариды ГК (20–38 дисахаридов), способны не только моментально гидратировать глубокие слои кожи, но и, что наиболее значимо, обеспечивать стимуляцию фибробластов, воздействуя на специфические рецепторы. Инъекционное введение в дерму гиалуроновой кислоты в виде коротких фрагментов оказывает выраженное стимулирующее действие, поскольку позволяет сократить этап дефрагментации длинных цепочек ГК под действием гиалуронидазы.
Биостимуляция дермы препаратами SKIN
Вышеописанные процессы лежат в основе биостимуляторов SKIN (Italfarmacia, Италия). В линейке представлено 4 препарата, в состав которых входит низкомолекулярная гиалуроновая кислота, состоящая из 28–30 мономеров, и ряд аминокислот в высоких концентрациях. Именно количество этих аминокислот является ключевым фактором для синтеза дермальных компонентов. Препараты SKIN зарегистрированы в России и Европе как медицинские изделия с классом безопасности III и имеют многолетнюю историю применения и безупречную репутацию на рынке инъекционных препаратов.
При всей своей схожести эти препараты отличаются друг от друга составом аминокислотного кластера, присутствием дополнительных компонентов и, соответственно, показаниями к применению и оказываемыми эффектами. Например, в препарате SKIN-B содержится 9 аминокислот в общем количестве 75 мг, а в SKIN-R – 3 аминокислоты, но их суммарное количество достигает 245 мг, что обеспечивает выраженный стимулирующий эффект.
- Препарат SKIN-B содержит буферный бикарбонат (рН = 7,4), который предотвращает закисление дермы, сопровождающее любое воспаление в тканях, в том числе травматического генеза, возникающего при проколе кожи иглой. Основными показаниями к применению SKIN-B является улучшение состояния дермы, нормализация физиологических процессов, а также стимуляция выработки нативной гиалуроновой кислоты, эластина и ретикулярного коллагена III типа.
- SKIN-R в противоположность SKIN-B имеет низкий уровень рН 5,6. Сдвиг в сторону кислотности является травмирующим фактором, который при наличии в составе гипертонического раствора аминокислот запускает процесс биореструктуризации дермы с образованием фиброзного коллагена I типа, который, в свою очередь, уплотняет дерму и дает выраженный лифтинг даже за 1 процедуру.
- Препарат SKIN-OX помимо низкомолекулярной ГК и аминокислотного комплекса имеет в составе витамин С и глутатион, тем самым обеспечивая дополнительную антиоксидантную защиту клеток кожи, в том числе при негативном влиянии УФ-лучей, укрепляет микроциркуляторное русло, корректирует нарушения пигментации, снижает хроническое воспаление в тканях и является мощным инструментом в борьбе с возрастным оксидативным стрессом.
- Препарат SKIN-COLIN имеет в составе холин, являющийся предшественником ацетилхолина. Известно, что холин, согласно принципам эндомодуляции, приводит к повышению синтеза эпидермального ацетилхолина и активации эпидермальной холинергической системы, регулируя тем самым процессы формирования эпидермального барьера, пролиферации кератиноцитов, улучшая микроциркуляцию и ангиогенез. Применение SKIN-COLIN ускоряет процессы репарации и способствует разглаживанию мелких морщин и уменьшению накоплений липофусцина.
Полную версию статьи со схемами и изображениями читайте в научно-познавательном журнале МЕТАМОРФОЗЫ 2024/45.
Исмаилова Наталья Супьяновна к.м.н., врач-косметолог, член Американской академии эстетической медицины, сертифицированный тренер компании Ipsen, научный руководитель ГК «МЕЛИС», главный врач клиники «МЕЛИС», Москва
В статье Наталья Супьяновна делится тем, какой должна быть идеальная нить, каким образом нити воздействуют на ткани и какие виды нитей используются в схемах тредлифтинга, а также поделится клиническим случаем с применением нитей EPITICON 19G.
Какой должна быть идеальная нить для лифтинговых техник
Очевидно, что материал должен быть биодеградируемым. Нить должна иметь форму, позволяющую гарантировать надежное сцепление с тканями, достаточную эластичность и механическую прочность на растяжение и, наконец, быть способной вызывать целевые биологические реакции в тканях. Чтобы добиться хороших клинических результатов и максимально избежать осложнений, врачи должны тщательно выбирать оптимальные нити с учетом их состава и размерного ряда.
Комплексное воздействие
Действие нитей базируется на биологическом ответе на механическое повреждение тканей иглой/канюлей в процессе имплантации и на инородное тело, имплантируемое в эти ткани. Среди основных факторов, определяющих воздействие мезонитей на клетки дермы, является воспаление, механосенситивность внеклеточного матрикса и биохимическая активность/инертность.
1. Воспалительный ответ – это реактивное изменение клеток в ответ на повреждение, инфицирование и другое воздействие на ткани, характеризующееся привлечением к месту повреждения нейтрофилов и макрофагов, усилением кровообращения и обменных процессов, увеличением скорости и количества делений клеток и синтеза межклеточного вещества дермы. Повышенная пролиферативная активность приводит при нормальном протекании процесса к регенерации и ремоделированию тканей.
Результаты исследований подтверждают, что при введении в дерму всех типов биодеградируемых нитей (рассматривались нити из материалов PDO, PCL, PLA, в том числе нити из комбинированных материалов) отмечается увеличение присутствия факторов роста, а именно TGF-β1 (трансформирующий фактор роста бета), EGF (эпидермальный фактор роста), IGF (инсулиноподобный фактор роста), VEGF (фактор роста эндотелия сосудов), семейства FGF (факторы роста фибробластов). Уровень содержания TGF-β1 и рост процентного содержания коллагена в дерме достигает максимального значения спустя 1 месяц после процедуры постановки нитей и сохраняет значимые показатели более полугода.
Зона, окружающая введенные нити, помимо интенсивной инфильтрации воспалительными клетками, характеризуется присутствием свойственной для процесса регенерации молодой соединительной (грануляционной) ткани, усилением пролиферации фибробластов и выраженным ангиогенезом. Процесс включает в себя как удлинение уже сформированных сосудов, так и рост новых капилляров, образование высокопроницаемых структур (так называемых синусоидных, перфорированных капилляров), пролиферацию и миграцию эндотелиоцитов, что приводит к увеличению и усложнению сосудистой сети. Результатом становится усиление микроциркуляции, питания и оксигенации тканей. Повышение дренирования тканей в определенной степени способствует снижению пастозности, особенно свойственной для пациентов с деформационно-отечным морфотипом старения.
2. Механосенситивность – реакция клеток на изменение в их физическом окружении при механическом воздействии (сдавливании, растяжении, напряжении и т.п.) с целью поддержания гомеостаза в тканях. Все живые клетки обладают способностью преобразовывать механические силы. Этим в том числе обусловлен эффект роста мышечной и костной ткани при интенсивных профессиональных и спортивных нагрузках. В бьюти-индустрии в какой-то степени спекулятивно этим обосновывается применение компрессионных масок и фейсбилдинга. В доказательной медицине изменения вязкоупругих свойств внеклеточного матрикса подтверждены рядом исследований.
На клеточном уровне механическое воздействие активирует и модулирует белковый синтез, пролиферацию и миграцию клеток. При деформации растяжения в клетках соединительной ткани индуцируется выработка коллагена и эластина с преимущественным образованием коллагена (больше в 3 раза). Двусторонняя связь между внеклеточным матриксом и фибробластами осуществляется с помощью белков интегринов, связанных с внутриклеточными механочувствительными адаптерами и сигнальными белками. Основными сенсорами, преобразующими механические стимулы, действующие на мембраны живых клеток, в электрические или химические внутриклеточные сигналы, являются механочувствительные каналы клеток. Они реагируют на растяжение и сжатие мембраны, давление на клетку.
Стимулом, запускающим биохимическую реакцию на механическое воздействие, оказывается и проводник нити в момент процедуры, и сама нить на всем протяжении нахождения в тканях. То есть чем медленнее протекает процесс резорбции нитей, тем более выраженный эффект терапии достигается.
3. И в последнюю, но не менее значимую очередь действие нитей определяется их химическим составом. Влияние полимолочной кислоты направлено на стимуляцию выработки коллагена в организме путем воздействия на рецепторы фибробластов по типу лиганда. У нитей PDO и PCL отсутствует химическая стимуляция коллагеногенеза в отличие от PLA, что в том числе определяет минимальный уровень воспалительной реакции при их использовании.
Сама возможность работы с пациентами, имеющими риск развития аутоимунных реакций или склонность к образованию келлоидов, определяется специалистом в индивидуальном порядке. Если принято положительное решение о возможности терапии, то средством первого выбора являются нити из полидиоксанона благодаря высокому профилю безопасности материала. Но при исключенном биохимическом воздействии и сведенном к необходимому минимальному уровню воспалительного ответа на первый план выходит принцип механического стимулирования, связанный с прочностно-эластичными свойствами нитей.
Коги и молды
В схемах нитевого лифтинга применяются два типа нитей – с насечками (так называемые коги – Cog) – и с зубцами (молды – Mold), отличающиеся принципом формирования фиксирующих элементов. Если в первом случае они образуются путем насечек на теле нити с уменьшением толщины нити в месте насечки, то у молдов зубцы формируются способом прессования, и их наличие не уменьшает диаметр нити. Чем больше диаметр нити, тем дольше она сохраняет прочность на разрыв и дольше находится в месте имплантации и наоборот. Места насечек у нитей Cog являются слабым местом и в плане устойчивости к растяжению, и в отношении деградации материала – резорбция нитей Cog в первую очередь наблюдается в областях с меньшим диаметром.
Полную версию статьи читайте в научно-познавательном журнале "Метаморфозы" 2023/44.
Исмаилова Наталья Супьяновна к.м.н., врач-косметолог, член Американской академии эстетической медицины, сертифицированный тренер компании Ipsen, научный руководитель ГК «МЕЛИС», главный врач клиники «МЕЛИС», Москва
Старение – это сложный процесс, происходящий под воздействием как экзогенных, так и эндогенных факторов. В патогенезе старения кожи важная роль принадлежит UV-повреждению, окислительному стрессу и сбоям в функционировании межклеточного экстрацеллюлярного матрикса. Такие процессы, как снижение количества и качества коллагеновых волокон, уменьшение процента содержания гиалуроновой кислоты, хроническое воспаление дермы, формируют порочный круг, оказывающий угнетающее влияние на активность фибробластов. Негативные изменения межклеточного окружения не являются возраст-ассоциированными и могут провоцировать повреждения клеток даже у достаточно молодых людей.
Роль металлопротеиназ в старении кожи
Известно, что с возрастом в коже повышается количество матричных металлопротеиназ (ММП): коллагеназ, желатиназы, стромелизины, ММП-1, ММП-9, ММП-3, ММП-11 и др. В коже человека ММП-1 является основной протеазой, которая запускает фрагментацию коллагенов I и III типов за счет расщепления коллагеновых фибрилл в одном месте внутри центральной тройной спирали. Далее в процесс вовлекаются другие металлопротеиназы: ММП-3 и ММП-9.
Но дермальные коллагеновые фибриллы стабилизированы поперечными связями, обладающими высокой устойчивостью к протеолитическому расщеплению, что приводит постепенно, в течение десятилетий, к накоплению в коже возникших в результате активности ММП сшитых фрагментов коллагена, нарушающих структуру и функцию кожного экстрацеллюлярного матрикса. Такая фрагментация коллагена является следствием повышенного содержания ММП, которое может происходить под влиянием окислительного стресса и свободных радикалов.
В работах Fischer G. убедительно продемонстрировано, что окислительное повреждение белка значительно (в 2 раза) увеличивается в коже пожилого человека по сравнению с молодой кожей. Кроме того, в возрастной коже был повышен уровень коллагеназ. Клеточная культура кожи молодого человека, подверженная воздействию ММП-1, проявляла все черты возрастной: истончались коллагеновые фибриллы, снижалась их плотность, появлялась фрагментация фибрилл, фибробласты становились округлыми, что не соответствовало картине здоровой, не обработанной ММП-1 кожи, в которой фибробласты растянутые и большего размера.
Коллагеновые волокна при старении
Когда здоровые фибробласты молодого человека помещали в среду с поврежденным экстрацеллюлярным матриксом, в котором содержался фрагментированный, структурно дефектный коллаген, они начинали проявлять черты, свойственные возрастной коже, а именно становились меньше по размеру, вырабатывали повышенный уровень окислителей и содержали повышенный уровень окисленных белков. Такие фибробласты имели уменьшенную площадь цитоплазмы и значительно сжимались в размерах, в то время как дермальные фибробласты, культивированные в неповрежденных коллагеновых решетках, имели растянутый уплощенный вид. Связано это с тем, что фрагментированный коллаген снижает механическое напряжение фибробластов в трехмерной решетке. У фибробластов площадь соприкосновения с коллагеновыми фибриллами становится меньше, что снижает их активность.
Аминокислоты и их роль в коллагеностимуляции
В связи с этим возникает большой интерес к механизму действия сочетания аминокислот с гиалуроновой кислотой (ГК) в составе биостимулирующих комплексов. Таким сочетанием обладают препараты SKIN (компания Italfarmacia).
Гиалуроновая кислота будет и восстанавливать гидратацию дермы, и оказывать стимулирующее действие на фибробласты за счет активации специфических рецепторов СD-44. Наибольшую активность, направленную на усиление пролиферации, клеточное деление и миграцию и усиление васкуляризации, будут проявлять короткие фрагменты гиалуроновой кислоты, что подтверждается рядом научных публикаций.
Низкомолекулярная ГК обладает стимулирующим действием и является активатором необходимых процессов. И именно низкомолекулярная ГК, состоящая из 20–38 мономеров, содержится в препаратах SKIN.
Биостимуляторы SKIN и их коллагеностимулирующее действие
Результат коллагеностимулирующего действия препаратов SKIN доказан в исследовании, проведенном в Италии, в котором принимали участие 20 женщин в возрасте 35–64 лет (в среднем 45 лет), 8 из них достигли менопаузы, а 12 были детородного возраста. Пациентки проходили лечение препаратами на основе гиалуроновой кислоты и аминокислот (SKIN-B) по методике мезотерапии курсом, состоящим из 4 процедур.
Эхографическое исследование показало увеличение толщины дермы в области глабеллы, кантальной области, скул, подбородка, шеи и угла нижней челюсти со средним результатом + 27,3%, что является статистически значимым показателем. Гистологическая оценка демонстрировала повышенную активность фибробластов с образованием ретикулярного коллагена III типа и увеличением количества сосудов и толщины эпидермиса.
Наблюдались высокая репликативная активность эпидермиса с положительной иммуногистохимической реакцией на эпидермальный фактор роста (EGF) и увеличение содержания коллагеновых волокон без патологического присутствия воспалительных клеток.
Полную версию статьи вы можете прочитать в научно-познавательном журнале "Метаморфозы" 2023/44.
Авторы: Исмаилова Наталья Супьяновна, к.м.н., MD-PhD, врач-косметолог, член Американской академии эстетической медицины, сертифицированный тренер компании Ipsen, научный руководитель ГК МЕЛИС, Москва
Салтаханова Мелиса Мурадовна, студентка 6-го курса Медицинского института ФГАОУ ВО «Российский университет дружбы народов им. Патриса Лумумбы» Минобрнауки РФ, направление «Лечебное дело», сотрудник центра косметологии и стоматологии «Мелис», Москва
Статья посвящена природе мелазмы и научной аргументации в пользу пересмотра традиционных способов ее коррекции. Авторы докажут эффективность PRP-терапии в борьбе с гиперпигментацией и представят результаты в обзоре последних опубликованных научно-практических исследований.
После окончания летнего сезона наиболее популярной причиной обращения к косметологу является жалоба на гиперпигментацию, которая развивается и усиливается под действием ультрафиолетового излучения. Эта эстетическая проблема создает для пациентов серьезный дискомфорт, и задача специалистов – предложить эффективное и безопасное решение, чтобы в наиболее сжатые сроки и без серьезной реабилитации получить хороший депигментирующий эффект. Одним из распространенных видов дисхромии является мелазма.
Мелазма: что мы о ней знаем
Мелазма – хроническое заболевание кожи, связанное с избыточной выработкой меланина на участках, подверженных воздействию ультрафиолетового излучения, характеризующееся коричневыми пятнами неправильной формы и возникающее обычно на лице, реже – на шее или других участках кожи. В патогенезе образования мелазмы лежит несколько причин: генетическая предрасположенность, гормональные изменения и ультрафиолетовое излучение.
Меланин: как его контролировать?
Меланин содержится в клетках базального слоя эпидермиса – меланоцитах, где образуется в цитозольных органеллах – меланосомах. С возрастом количество меланоцитов, находящихся в неподверженных инсоляции участках кожи, уменьшается на 6–8% с каждым десятилетием. При этом интересно отметить, что у представителей различных рас плотность меланоцитов одинакова. Пигментация же зависит от активности меланоцитов, от пропорции феомеланина и эумеланина и от их распределения.
Синтез меланина протекает с участием фермента тирозиназы. Наиболее распространенным методом подавления избыточного синтеза меланина является ее ингибирование. С этой целью применяются различные вещества, такие как гидрохинон, арбутин, коевая, аскорбиновая, азелаиновая, транексамовая кислоты и т.д. в виде наружных препаратов: кремов, лосьонов, сывороток и химических пилингов. Из физических методов лечения хорошо зарекомендовали себя метод селективного фототермолиза с помощью лазеров и IPL-методики широкополосным длинноимпульсным светом. Применяются также инъекционные методы: от введения мезотерапевтических препаратов до нейропротеинов, однако нередко это является off-label-протоколами. Поэтому сейчас хотелось бы обратить внимание на возможности безопасной инъекционной методики, которая доказала свою эффективность в мировой практике. Речь идет о PRP-терапии.
Мировой опыт применения PRP для лечения мелазмы
В статье Abd Elraouf IG с соавт. [3] было описано исследование, в котором сравнивалась эффективность лечения мелазмы при помощи транексамовой кислоты и PRP. Было отобрано 40 пациентов с III и IV фототипами кожи, с мелазмой всех форм и типов, в возрасте от 27 до 52 лет. Транексамовая кислота вводилась на правую половину лица, а PRP – на левую. Все пациенты параллельно использовали солнцезащитные кремы с SPF выше 30. Проводилось три процедуры каждые четыре недели с фотофиксацией до лечения и спустя три месяца после завершающей процедуры. При помощи индекса mMASI была проведена оценка эффективности терапии. На стороне, обрабатываемой ТК, до лечения индекс составлял 4,59 ± 2,87. Спустя три месяца – 2,49 ± 1,58 со снижением на 45%. На стороне, обрабатываемой PRP, до лечения индекс составлял 4,72 ± 2,72. Спустя три месяца был равен 2,17 ± 1,41 со снижением на 54%.
В другом исследовании K. Gharib и соавт. [4] приняло участие 26 пациентов в возрасте от 26 до 50 лет, которых поделили на две группы по 13 человек для лечения ТК и PRP соответственно. Измерение индекса mMASI велось после каждой из четырех процедур. После лечения пациентов с применением PRP индекс mMASI уменьшился почти на 65% (с 6,84 ±3,37 до 3,08 ±1,99), а при лечении ТК – на 45% (с 9,06 ±2,95 до 5,89 ±3,41). Авторы статьи рекомендуют использование PRP для лечения данной патологии.
В исследовании A. Tuknayat с соавт. [10] 40 пациентам вводили PRP с периодичностью один раз в месяц. Было проведено три таких сеанса PRP, пациенты наблюдались в течение 3 месяцев. Оценка проводилась путем расчета индекса mMASI. Пациентов также просили оценить свое состояние. В конце исследования наблюдалось среднее снижение показателя mMASI на 54,5%. Рецидива не было ни у одного больного. Более 90% пациентов были удовлетворены или очень довольны результатами. Значимых побочных эффектов не наблюдалось.
Почему PRP уменьшает гиперпигментацию
Терапевтический эффект плазмы, обогащенной тромбоцитами, связан с действием факторов роста, которые содержатся в альфа-гранулах. Известно более 30 биологических активных веществ, могущих оказывать различные влияния на клетки и ткани. В борьбе с гиперпигментацией на сегодняшний день доказано значение, по крайней мере, двух из них: TGF-β1 и EGF.
Исследования, проведенные Yun W.J. с соавт. [12], выявили, что эпидермальный фактор роста EGF обладает антимеланогенным действием, снижая продукцию меланина в меланоцитах путем ингибирования простагландина Е2 и активность фермента тирозиназы. Трансформирующий фактор роста бета-1 играет ключевую роль в клеточной пролиферации, дифференцировке и апоптозе.
D.S. Kim с соавт. [13] исследовал влияние TGF-β1 на меланогенез, используя спонтанно иммортализованную клеточную линию меланоцитов мыши Mel-Ab. Его результаты показали, что TGF-β1 значительно ингибирует синтез меланина в зависимости от концентрации, снижает активность тирозиназы и связанных с тирозиназой белков TRP-1 и TRP-2, а также влияет на транскрипционный фактор, связанный с микрофтальмией (MITF), который регулирует пролиферацию меланоцитов и структурных белков меланосом.
PRP, которая дает результат
В связи с вышесказанным особо хотелось бы выделить пробирки T-Lab PRP Tube (T-Biyoteknoloji LTD, Турция, № РЗН 2020/12523), которые отвечают всем требованиям, предъявляемым к изделиям, пригодным для получения аутологичной плазмы, и дают возможность получать разные виды PRP. Пробирки T-Lab PRP Tube не имеют в своем составе разделительного геля и содержат антикоагулянт цитрат натрия, который разработан эксклюзивно для этого изделия. Именно данный антикоагулянт дает возможность получить достаточное количество трансформирующего фактора роста TGF-β1, который отвечает за депигментирующее действие плазмы, а также обеспечивает максимальную сохранность тромбоцитов.
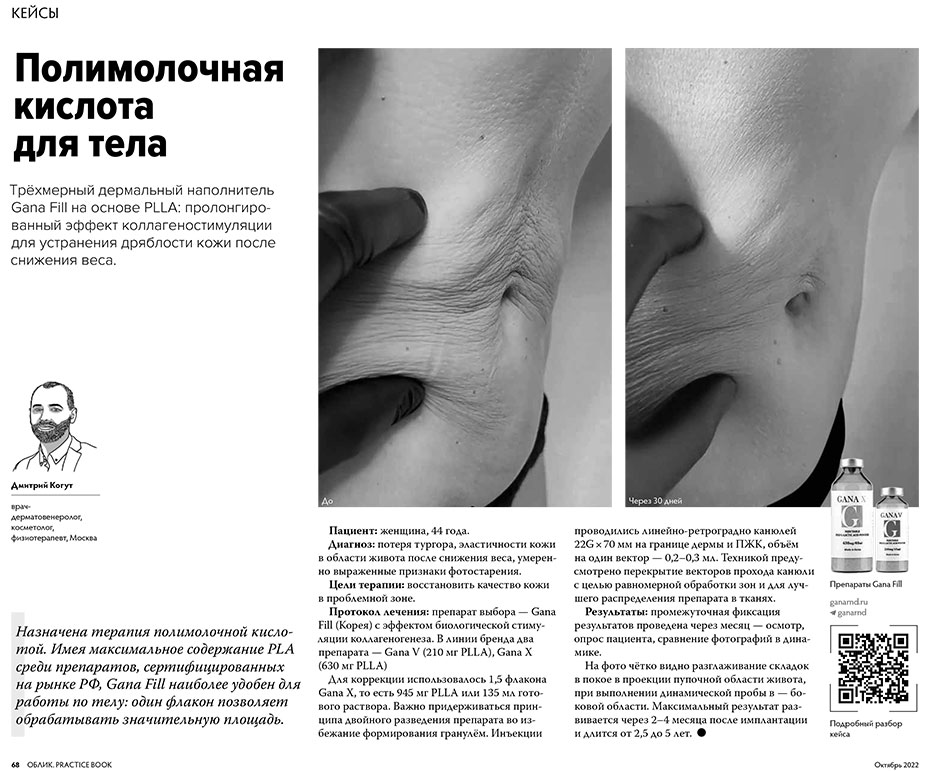
Литература
[1] Вашкевич Ю.И., Крумкачев В.В. Анализ применения транексамовой кислоты для лечения мелазмы // Клиническая дерматология и венерология. – 2021 – № 20(1). – С. 157–163. [2] Шаруханова А.А. Клинико-лабораторное обоснование дифференцированной терапии мелазмы у женщин: дис. … канд. мед. наук. – М., 2018 [3] Abd Elraouf I.G., Obaid Z.M., Fouda I. Intradermal injection of tranexamic acid versus platelet-rich plasma in the treatment of melasma: a split-face comparative study. Arch Dermatol Res, 315(6): 1763–1770, 2023 [4] Gharib K., Mostafa F.F., Ghonemy S. Therapeutic Effect of Microneedling with Platelet-rich Plasma Versus Microneedling with Tranexamic Acid for Melasma. J Clin Aesthet Dermatol, 14(8): 44–48, 2021 [5] Sirithanabadeekul P., Dannarongchai A., Suwanchinda A. Platelet-rich plasma treatment for melasma: a pilot study. Journal of Cosmetic Dermatology, 19(6):1321–1327, 2020 [6] Zhao L., Hu M., Xiao Q., Zhou R., Li Y., Xiong L., Li L. Efficacy and Safety of Platelet-Rich Plasma in Melasma: A Systematic Review and Meta-Analysis. Dermatol Ther (Heidelb), 11(5): 1587–1597, 2021 [7] Cayırlı M., Calışkan E., Açıkgöz G., Erbil A.H., Ertürk G. Regression of melasma with platelet-rich plasma treatment. Ann Dermatol., 26(3): 401–2, 2014 [8] Hofny E.R.M., Abdel-Motaleb A.A., Ghazally A., Ahmed A.M., Hussein M.R.A. Platelet-rich plasma is a useful therapeutic option in melasma. J Dermatolog Treat. 30(4): 396–401, 2019 [9] González-Ojeda A., Ciocian o J.M., Cervantes-Cardona G.A., Acevedo-Guzman D., Puebla- Mora A.G., Cortés-Lares J.A., Chávez-Tostado M., Álvarez-Villaseñor A.S., Cervantes-Pérez E., Ramos-Álvarez M.P., Pacheco-Vallejo L.R., Barbosa-Camacho F.J., Fuentes-O rozco C. Treatment of melasma with platelet-rich plasma: A self-controlled clinical trial. Dermatol Ther., 35(9), 2020 [10] Tuknayat A., Thami G.P., Bhalla M., Sandhu J.K. Autologous intralesional platelet rich plasma improves melasma. Dermatol Ther., 34(2), 2021 [11] Farzana Faiz, Atif Shehzad, Rabia Farooq, Shaiqa Mufti, Asma Nasir, Tahir Jamil Ahmad, Journal of Pakistan Association of Dermatologists., 28(3): 348–353, 2017 [12] Yun W.J., Bang S.H., Min K.H., Kim S.W., Lee M.W., Chang S.E. Epidermal growth factor and epidermal growth factor signaling attenuate laser-induced melanogenesis. Dermatol Surg., 39: 1903–11, 2013 [13] Dong-Seok Kim, Seo-Hyoung Park. Transforming growth factor-beta1 decreases melanin synthesis via delayed extracellular signal-regulated kinase activation, Int J Biochem Cell Biol., 36(8): 1482–91, 2004 [14] Hofny E.R.M., Hussein M.R.A., Ghazally A., Ahmed A.M., Motaleb A.A. Increased expression of TGF-β protein in the lesional skins of Chloasma patients following treatment with platelet-rich plasma. Journal of Cosmetic and Laser Therapy., 21(7–8): 382–389, 2019 [15] Ci Zhang, Tianpeng Wu, and Nan Shen Pak, Effect of platelet-rich plasma combined with tranexamic acid in the treatment of melasma and its effect on the serum levels of vascular endothelial growth factor, endothelin-1 and melatonin, J Med Sci., 38(8): 2163–2168, 2022 [16] Imokawa G. Autocrine and paracrine regulation of melanocytes in human skin and in pigmentary disorders. Pigment Cell Res., 17(2): 96–110, 2004 [17] Ning Zhang, Ketao Wang, Zhongli Li, Tao Luo, Comparative study of different anticoagulants and coagulants in the evalution of clinical application of platelet-rich plasma (PRP) standardization, Cell Tissue Bank, 20(1): 61–75, 2019 [18] Alper Murat Ulasli, Gokhan Tuna Ozturk, Bagdagul Cakir. The effect of the anticoagulant on the cellular composition and growth factor content of platelet-rich plasma, Cell Tissue Bank, 23(2): 375–383, 2022 [19] Magalon J., Chateau F.L., Betrand B., Louis M.L. et all. DEPA classification: a proposal for standardising PRP use and a retrospective application of available devices, BMJ open Sport Exerc Med, 2(1), 2016
Полную версию статьи читайте в научно-познавательном журнале "Метаморфозы" 2023/43.
Журнал Облик. Practice Book №4 (53), октябрь 2023.
Автор: Лебедев Дмитрий Вячеславович, врач-пластический хирург, врач-косметолог, тренер и спикер по нитевому лифтингу, член Национального общества реконструктивной микрохирургии, тренер Учебного центра ГК МЕЛИС.
Нитевой лифтинг позволяет восстановить нормальное или сформировать более эстетически привлекательное положение бровей. Показаниями для процедуры являются: опущение уголков бровей, нависание кожных складок верхнего века, врожденное или приобретенное низкое расположение или асимметрия бровей, осложнения после ботулотоксина и птоз бровей. При коррекции возрастных изменений или врожденных особенностей верхней трети лица врач-косметолог не только перемещает ткани, но и формирует целостный и эстетичный образ. При этом само строение данной области отнюдь не упрощает задачу: с одной стороны, нити должны удерживать ткани в заданном положении, несмотря на высокую мимическую активность данной зоны, с другой – тонкая кожа и обычно маловыраженная прослойка ПЖК не позволяют применить толстые нити во избежание возможного просвечивания и контурирования.
КЕЙС №1. ЛИФТИНГ ВЕРХНЕЙ ТРЕТИ ЛИЦА
Пациент: женщина, 50 лет. Хронических заболеваний, препятствующих процедуре, не выявлено, гормональный статус в норме. Морфотип старения: деформационно-отечный. Жалобы: нависание верхних век, усталый вид лица.
Протокол терапии:
- За 2 недели до процедуры проведена инъекция БТА в m. frontalis, m. corrugator, m. procerus, m. orbicularis oculi с целью уменьшения активности мышц, снижения риска смещения нитей и пролонгации клинического эффекта.
- На предварительном этапе проведены антисептическая обработка и инфильтрационная анестезия в области коррекции.
- 8 нитей Epiticon 18G (по 4 на каждую сторону) поэтапно имплантированы в ПЖК в область латеральной части брови в технике V-shape. Сначала по 2 нити установлено справа и слева. Точки введения – на 5 мм ниже брови, от латерального края и от средне-зрачковой линии с общей точкой фиксации в верхней височной септе. Произведено перемещение нависших тканей в вертикальном векторе и одновременное извлечение двух проводников.
- Далее повторное введение нитей по 2 на каждую сторону по вышеописанной схеме для более надежной фиксации тканей.
- После процедуры наложены асептические стрипы.
РЕЗУЛЬТАТЫ КОРРЕКЦИИ: легкий отек и болезненность в зоне коррекции прошли спустя несколько дней. Субъективно пациент отметил уменьшение нависания верхних век. Лицо приобрело более свежий и молодой вид. Молд-нити Epiticon применялись для коррекции положения бровей, подтяжки верхнего века и уменьшения выраженности латерального кантуса.
КЕЙС №2. УСТРАНЕНИЕ АСИММЕТРИИ ЛИЦА
Пациент: женщина, 47 лет. Хронических заболеваний, препятствующих процедуре, не выявлено, гормональный статус в норме. Морфотип старения: деформационно-отечный. Жалобы: неровное расположение бровей.
Протокол терапии:
- За 2 недели до процедуры была проведена инъекция БТА в m. frontalis, m. corrugator, m. procerus, m. orbicularis oculi с целью уменьшения активности мышц, снижения риска смещения нитей и пролонгации клинического эффекта.
- С учетом показаний у пациента был выбран протокол установки молд-нитей Epiticon 18G с участками с зубцами 9 см (96 якорных элементов) только с правой стороны лица.
- После антисептической обработки и анестезии в зону коррекции глубоко в ПЖК было имплантировано 4 нити в области латерального участка брови, точки введения – на 0,5 ниже линии бровей, точка фиксации – верхняя височная септа.
- Предварительное перемещение тканей перед имплантацией крайне важно, так как особая форма двунаправленных выступов мгновенно фиксирует ткани в целевой зоне, после постановки смещение нити невозможно.
РЕЗУЛЬТАТЫ КОРРЕКЦИИ:симметричное положение обеих бровей наблюдается сразу после выполненной коррекции. Достигнуты: подъем латерального угла глаза справа, уменьшение нависания верхнего века справа и общая гармонизация контуров периорбитальной области.
Полную версию статьи читайте в коллекционном сборнике мастер-классов Practice Book №4 (53) от ИД "Облик".
Авторы: Халина Елена Сергеевна, врач-дерматовенеролог, косметолог, трихолог, ведущий специалист и сертифицированный тренер Учебного центра ГК МЕЛИС; Овчаренко Татьяна Андреевна, клинический анатом.
- КЛИНИЧЕСКИЙ СЛУЧАЙ №1
Пациент – женщина, 50 лет. Жалобы: снижение тонуса кожи, ухудшение овала лица, усталый вид, появление носогубных складок, морщины нижнего века, опущенное верхнее веко, мимические морщины.
Была проведена однократная процедура введения препарата Skin-R в зону верхней трети лица и в область верхнего и нижнего века папульно техникой «точка за точкой». Результат оценивался через три недели. Пациент отмечает значительное уплотнение кожи верхнего и нижнего века, уменьшение «нависания» верхнего века.
Препарат линии Skin (Italfarmacia, Италия) Skin-R является уникальным, не имеющим аналогов по своему составу. Гиалуроновая кислота представлена в виде коротких от 20 до 38 мономеров. Такой размер молекул не притягивает много свободной воды, что исключает риск отечности даже в периорбитальной зоне. Также этот размер оптимален при стимуляции рецепторов СD-44 на поверхности фибробластов, что способствует выработке коллагена III типа. Препарат содержит необходимый набор аминокислот в L-форме (пролин, лизин), а также глицин, составляющие более 50 % аминокислотного состава коллагенового волокна и являющиеся для него специфичными. Skin-R имеет кислый pH 5,8, тогда как рН внутриклеточной жидкости составляет 7,0-7,4. Воспалительная реакция, запускаемая кислым агентом, протекает с участием клеток макрофагального ряда, которые взаимодействуют с фибробластами и активируют СD-40 рецептор. Результатом является усиление синтеза коллагенов, в особенности коллагена I типа и приостанавливает работу металлопротеиназ. Фибротический коллаген является следствием активированного клеточного иммунного ответа и вызывает сокращение площади растянутой кожи.
- КЛИНИЧЕСКИЙ СЛУЧАЙ №2
Пациент – женщина, 46 лет. Жалобы на пигментацию в области лица, особенно в области лба, которая появилась более трех лет назад.
Было проведено четыре процедуры введения препарата Skin-OX внутридермально папульно, обработка проводилась не только зон с гиперпигментацией, но и периорбитальной области и области шеи. Инъекции проводились один раз в 10 дней. Оценка результата проводилась через шесть недель от начала терапии. Пациент отмечает значительное осветление пигментации, улучшение качества и текстуры кожи, уплотнение и уменьшение морщин. Терапию можно продолжить и усилить благодаря PRP, что было рекомендовано пациенту.
Препарат Skin-OX содержит низкомолекулярную гиалуроновую кислоту (20-38 мономеров), аминокислоты в физиологически активной L-форме, глутатион, витамин С в стабилизированой форме аскорбил гликозида, имеет фосфатный буфер, поддерживающий pH 7,0. Антиоксидантная система универсального биоревитализанта Skin-OX – витамин С, глутатион и цистеин – эффективно предотвращает негативное влияние ультрафиолетовых лучей и помогает устранить эстетические проблемы, возникшие в результате возрастных изменений и чрезмерной солнечной инсоляции.
PRP-терапия может усилить эффект осветления в терапии дисхромий любого генеза. Это связано с факторами роста, содержащимися в PRP. Терапия концентрированной плазмой не только устраняет имеющиеся очаги гиперпигментации, но и предотвращает появление новых. Пробирки T-lab PRP Tube позволяют получить все виды PRP и имеют III класс безопасности, антикоагулянт цитрат натрия гарантирует максимальную выживаемость тромбоцитов после центрифугирования.
- КЛИНИЧЕСКИЙ СЛУЧАЙ №3
Пациент – женщина, 68 лет. Жалобы на статические морщины лба. В анамнезе неудачная коррекция нейропротеином. Была предложена коррекция филлером Inobelle F+.
Статические морщины в области лба можно значительно уменьшить по глубине, используя мягкие пластичные филлеры в технике игольной сепаровки. Препарат Inobelle F+ обладает невысоким G-prime 200, умеренным молекулярным весом 1000 кДа – 20 мг/мл гиалуроновой кислоты и оптимальной пластичностью. Для коррекции потребовалось 0,5 мл препарата. Результат оценивали через 14 дней после процедуры. Пациент отметила значительное уменьшение глубины морщин.
Полную версию статьи читайте в коллекционном сборнике мастер-классов Practice Book №4 (53) от ИД «Облик».
Сначала 50-х годов ХХ века у специалистов появился значительный интерес к молекуле гиалуроновой кислоты (ГК). При первых попытках применения ГК возникла серьезная проблема, состоящая в недостаточной очистке сырья. В 1980-х гг., одним из первых препаратов ГК был Healon Pfizer, Inc., который использовали в офтальмохирургии, и с этого времени началось активное применение гиалуроновой кислоты в медицине [1].
Классические препараты для биоревитализации содержат нестабилизированную высокомолекулярную гиалуроновую кислоту.
Биоревитализация – метод восстановления и оптимизации качественных характеристик кожи, в частности межклеточного матрикса, путем проведения интрадермальных инъекций препаратов ГК. Основной целью данной методики является пополнение гидратационного резерва тканей и воссоздание в коже естественных условий для функционирования клеток и, таким образом, активации механизма ауторегуляции синтеза эндогенной гиалуроновой кислоты и других компонентов внеклеточного матрикса дермы [2].
Описать механизм действия гиалуроновой кислоты в мезотерапевтических препаратах затруднительно, так как производители в силу технических особенностей или корпоративной политики не могут гарантировать точный молекулярный вес ГК или сознательно не заявляют эту характеристику в документации.
Но все специалисты сходятся в том, что основное требование к выбираемому инъекционному препарату – его безопасность (биосовместимость) и способность обеспечить стабильный и пролонгированный результат коррекции.
Уже на протяжении 16 лет на рынке индустрии красоты в РФ успешно применяются препараты линейки Skin компании Italfarmacia.
Характеристика препаратов линии Skin
Skin-R, Skin-B, Skin-OX, Skin-Colin – это эндомодуляторы на основе низкомолекулярной ГК. Эффективность препаратов Skin базируется на химической уникальности их составов.
Линия Skin от других препаратов на основе ГК, предназначенных для биоревитализации, отличается молекулярным весом кислоты, буферной системой, аминокислотным комплексом, дополнительными модулирующими компонентами.
Наиболее мощными свойствами по индукции выработки нового коллагена в сочетании с хорошим ревитализирующим потенциалом обладает препарат Skin-R. Его можно отнести к биореструктуризантам и по механизму действия, и по получаемому результату. Механизм действия Skin R в первую очередь определяется действием гипертонического раствора (pH-фосфатного буфера 5,8), а также свойствами смеси ГК, состоящих из 20–38 мономеров и аминокислот (L-пролин, L-лизин, глицин). Буферные системы – бикарбонатная и фосфатная – с оптимальным значением pH оказывают протекторное действие на гомеостаз и функциональное состояние матрикса дермы [3].
Количество мономеров (20–38) в гиалуроновой кислоте в препаратах Skin подтверждено производителем Italfarmacia, патентом EP 2 203 222 B1 [3]. ГК длиной 20–38 мономеров более активно связывается с рецепторами CD44: максимальные цифры лежат в пределах 22<26<30<34
ГК такого размера обладает провоспалительным свойством, запускает процесс деградации неполноценных межклеточных элементов матрикса дермы и одновременно активирует пролиферативную функцию фибробластов, побуждая их к активной миграции в очаг воздействия. Препараты линейки Skin используются в терапии хроно- и фотостарения кожи, но вне фазы активного воспаления, индуцированного инсоляцией или иными причинами [4].
CD44 – специфический первичный рецептор клеточной поверхности для ГК, свойственный для разных типов клеток. Известна связь между активацией рецептора ГК CD44 и скоростью движения клеток. Данный механизм реализуется через МАРК-сигнальный каскад.
При связывании ГК с компонентами внеклеточного матрикса происходит кластеризация и активация CD44-рецепторов, что приводит к реорганизации цитоскелета и активации целого ряда сигнальных механизмов. CD44 является важным рецептором не только для связывания и запуска синтеза ГК, но и для движения фибробластов [5, 6]. Обработка олигомерами ГК эксцизионных ран приводит к образованию новых кровеносных и лимфатических сосудов, отложению коллагена [6, 7].
Кислотность раствора Skin-R (pH 5,8) – фактор умеренного раздражения дермы, который, воздействуя на внеклеточный матрикс, стимулирует процессы деградации накопленных поврежденных компонентов в нем с одновременной стимуляцией синтеза полноценных молекул. Препарат действует на клетки эпидермиса, макрофаги, перициты, фибробласты.
Под действием медиаторов воспаления запускаются механизмы активации сигнальных путей, отвечающих за формирование специфического фенотипа фибробластов (миофибробластов). Увеличение популяции миофибробластов приводит к активации фактора роста соединительной ткани CTGF и росту фиброзной ткани. Данные механизмы активации описаны не только в ответ на физический стресс, но и на гиперпродукцию провоспалительных цитокинов [5–7].
Миофибробласты синтезируют коллаген I, III, IV и VIII типов, фибронектин и тенасцин, а также компоненты базальной мембраны (ламинин). Они секретируют также матриксные металлопротеазы (MMP) 1, 2 и 3, разрушающие базальные мембраны и межклеточный матрикс. Это играет важную роль в ремоделировании ткани при повреждении. MMP1 разрушает коллаген I, II и III типов. MMP2 разрушает денатурированный коллаген I и III типов. MMP3 деградирует ламинин, фибронектин, протеогликаны. Активность металлопротеаз подавляется тканевым ингибитором металлопротеаз, также секретируемым миофибробластами. Тем самым создается замкнутая система ремоделирования межклеточного матрикса дермы.
Аминокислоты в составе препарата Skin-R принимают активное участие в синтезе первичных альфа-цепей коллагена. Аминокислотный компонент препарата содержит только самое основное – глицин, пролин, лизин (так как биохимический коллаген примерно на треть состоит из глицина согласно формуле GLY-XY).
Глицин – единственная протеиногенная аминокислота, не имеющая оптических изомеров, которая критически важна для формирования правильной пространственной конфигурации коллагеновых фибрилл. Замена глицина на какую-либо другую аминокислоту, имеющую более объемную боковую группу, например, серин, может привести к серьезным патологиям (к синдрому Элерса-Данлоса) [8].
Следующей наиболее распространенной аминокислотой является пролин или его производное – гидроксипролин. Пролин является сигнальной молекулой, датчиком энергетического статуса клетки и источником пирролин5-карбоксилата (P5C) и супероксиданиона (свободного радикала), участвующих в окислительно-восстановительных реакциях. Уникальная кольцевая структура пролина и гидроксипролина отличает их от других аминокислот с точки зрения жесткости, химической стабильности.
На этапах синтеза коллагена после включения пролина и лизина в полипептидную цепь происходит их гидроксилирование. Образование гидроксипролина и гидроксилизина катализируют железосодержащие ферменты – пролилгидроксилазу и лизилгидроксилазу, их кофактор – аскорбиновую кислоту. Происходит плотное закручивание первичных альфа-цепей.
Значение лизина в процессе коллагеногенеза сложно преуменьшить. После реакции гидроксилирования происходит реакция дезаминирования лизилоксидазой остатков лизина с образованием альдегидных групп, обладающих высокой реакционной способностью. Затем эти группы самопроизвольно реагируют с образованием ковалентных связей друг с другом или с другими остатками лизина или гидроксилизина. Формируются жесткие поперечные сшивки, стабилизирующие фибриллы.
Клинические показания для применения препарата SKIN-R
- Снижение тургора и эластичности кожи.
- Возрастная атрофия кожи.
- Выраженное истончение и дряблость кожи.
- Обезвоженная кожа.
- Птоз мягких тканей.
Зоны коррекции
- Верхняя, средняя, нижняя треть лица.
- Периорбитальная область.
- Шея, зона декольте.
- Область живота.
- Внутренняя поверхность бедра.
- Внутренняя поверхность плеч.
Описание клинического случая с применением биоревитализанта SKIN читайте в журнале МЕТАМОРФОЗЫ №42 Май 2023 года
Литература
- [1] Эстетическая мезотерапия и биоревитализация. – М.: Косметика и медицина, 2015. – 304 с.
- [2] Di Pietro A., Di Sante G., Il recupero dell’elasticità e del turgore cutaneo mediante iniezione intradermica di acido ialuronico (IAL-System®) con tecnica cross-linked, Est. da G Ital Dermatol Venereol, 136 #3,2001, pp. 187–194.
- [3] 22.08.2007 EP 07016441, Italfarmacia S.r.l. 00155 Roma (IT), Celestino, Marco ABM Agenzia Brevetti & Marchi, Viale Giovanni Pisano, 3156123 Pisa (IT).
- [4] Эстетическая мезотерапия и биоревитализация. – М.: Косметика и медицина, 2015. – 304 с.
- [5] Опухоль-ассоциированные фибробласты и их значение в прогрессии злокачественных новообразований / Н.А. Олейникова, Н.В. Данилова, И.А. Михайлов, Е.В. Семина, П.Г. Мальков // Архив патологии. – 2020. – № 82 (1). – С. 68–77.
- [6] Bourguignon L.Y., Lokeshwar V.B., Chen X., Kerrick W.G. Hyaluronan-CD44 interaction stimulates keratinocyte differentiation, lamellar body formation/secretion, and permeability barrier homeostasis J Invest Dermatol. 2006 Jun; 126(6): 1356–1365. doi: 10.1038/sj.jid.5700260, 16557236 DOI: 10.1038/sj.jid.5700260
- [7] Trabucchi E., Pallotta S., Morini M., Corsi F., Franceschini R.,Pravettoni A., Foschi D., Minghetti P. Low molecular weight hyaluronic acid prevents oxygen free radical damage to granulation tissue during wound healing. International journal of tissue reactions. 2002; 24 (2): 65–71. PMID: 12182235.
- [8] Lesley J., Hascall V.C., Tammi M., Hyman R. Hyaluronan binding by cell surface CD44. J Biol Chem. 2000 Sep 1; 275(35): 26967–75. PMID: 10871609 DOI: 10.1074/jbc.M002527200.
- [9] Семья с синдромом Элерса-Данлоса III типа/синдромом суставной гипермобильности имеет замену глицина 637 на серин в коллагене III типа / П. Нарцизи, Дж.А. Ричардс, С.Д. Фергюсон, Ф.М. Поуп // Молекулярная генетика человека. – 1994. – Т. 3, вып. 9. – С. 1617–1620.
На сегодняшний день инъекционный портфель врача-косметолога богат и разнообразен, но когда заходит речь о терапии возрастных изменений, перед специалистами возникает закономерный вопрос – какое действующее вещество выбрать: гиалуроновую кислоту, пептиды, коллаген, полимолочную кислоту, антиоксиданты, коктейль на основе витаминов? А главное, с какого возраста начинать ту или иную терапию?
При естественном биологическом старении происходит постепенное и нарастающее снижение активности фибробластов и уменьшение объема коллагеновых волокон в дерме. Под биологическим старением мы понимаем хронологическое и гормонально зависимое (менопаузальное) старение. Явные проявления деградации коллагена диагностируются в среднем в возрасте 35–40 лет и наиболее выражены в период менопаузы.
Но в группе пациентов с синдромом недеффенцированных дисплазий соединительной ткани симптоматика, связанная с нарушениями коллагеногенеза, диагностируется в среднем на 8–10 лет раньше предполагаемого срока.
НСДТ – наследуемые или врожденные нарушения соединительной ткани мультифакторной природы, характеризующиеся большим разнообразием и степенью выраженности проявлений.
В основе НДСТ лежат изменение скорости и объема синтеза коллагена и эластина, нарушение процентного соотношения между коллагеном I и III типов, а также их качественные изменения (нарушение структуры волокон вследствие их недостаточной поперечной сшивки).
В структуру дермы включены 12 из 29 типов коллагена. Таким образом, коллагенопатия несистемного характера в первую очередь затрагивает именно этот орган.
В симптоматику кожных проявлений НДСТ входят:
- сниженная плотность кожи на лице и теле;
- повышенная растяжимость;
- атоничность;
- стрии.
Одним из диагностических маркеров является формирование кожной складки в проекции угла нижней челюсти. В случае если кожу можно собрать в складку и оттянуть на два и более сантиметра.
Так как лимфа и кровь также относятся к соединительной ткани, у носителей синдрома может отмечаться нарушение водно-солевого обмена, пастозность тканей и склонность к отекам.
Помимо эстетических недостатков у таких пациентов может наблюдаться целый симптомокомплекс фенотипичеких проявлений, а именно: пролапс митрального клапана, варикозное расширение вен, плоскостопие, миопия и др.
Распространенность тех или иных проявлений НДСТ в популяции приводит к тому, что до четверти пациентов косметолога имеют признаки раннего старения кожи, связанные с нарушениями развития соединительной ткани.
Важно понимать, что для применения антивозрастной терапии в этом случае не обязательно ждать выраженных изменений, а работать на опережение. Ключом к успешной терапии является ранняя диагностика и комплексный подход.
В качестве основного инструмента anti-age-терапии современные специалисты все чаще останавливают свой выбор на полимолочной кислоте благодаря ее интенсивному коллагенстимулирующему эффекту, который проявляется в улучшении текстурных свойств кожи: улучшении тонуса, тургора и, как следствие, сокращении площади кожи, что дает истинный лифтинг-эффект.
Характеристики инъекционной поли-L-молочной кислоты. Препарат GANA FILL и его свойства
Инъекционная поли-L-молочная кислота (PLLA), которая представляет собой биосовместимый, биоразлагаемый синтетический полимер, является физиологичным субстратом для кожи, не вызывает отторжения или аллергических реакций, полностью биодеградируется ферментными системами, что подтверждается данными исследований in vitro, а также данными ультразвуковых сканирований кожи.
Считается, что механизм действия поли-L-молочной кислоты заключается в стимуляции реакции инородного тела, характеризующейся увеличением количества макрофагов, тучных клеток и лимфоцитов. Этот приток приводит к медленной деградации продукта – повышенной фибробластической активности и постепенному неоколлагеногенезу.
Однако клеточный каскад, связанный с инъекционной PLLA, происходит со временем и требует терпения как со стороны лечащего врача, так и пациента. Следовательно, применение инъекционной PLLA приводит к постепенному эффекту лечения.
Доказательства этого каскада и последующего образования коллагена предлагаются исследованиями результатов у пациентов с липоатрофией лица, связанной с вирусом иммунодефицита человека, показывающими, что лечение инъекционной PLLA приводит к увеличению толщины кожи, которая сохраняется до 2 лет.
У пациентов с коллагенопатиями, вызванными НСТД, терапия с применением поли-L-молочной кислоты дает выраженный отклик и позволяет скорректировать проявления синдрома.
Среди препаратов, зарегистрированных на российском рынке, особыми характеристиками обладает препарат GANA FILL (производство Южная Корея), а именно:
- в формуле представлены только L-изомеры с молекулярной массой 170 000, что повышает эффективность препарата;
- микрогранулы оптимального размера 30–50 нм;
- гранулы произвольной формы не имеют острых углов, что снижает риск гипервоспаления;
- пористая структура гранул способствует лучшей интеграции в тканях и равномерной фиксации фибробластов на их поверхности;
- концентрация PLLA в препаратах GANA FILL является самой высокой из всех средств на основе полимолочной кислоты, представленных в России в легитимном поле: 210 мг PLLA – GANA V и 630 мг PLLA – GANA X.
Одно из ярких преимуществ препаратов линии GANA FILL – это минимальное время суспензирования: оно составляет всего 5–10 мин и позволяет восстанавливать препарат в присутствии пациента непосредственно перед процедурой.
Какой пациент скорее и ярче получит результат от применения поли-L-молочной кислоты?
Критериями отбора являются: ведущий морфотип усталый, нормальный ИМТ, невысокая степень растяжения связок и кожного лоскута, возрастной диапазон 35–50 лет. Дополнительными условиями успешной терапии являются: нормальный образ жизни (сон 7–8 часов, сбалансированное питание с достаточным объемом нутриентов), отсутствие хронических заболеваний, низкий уровень стресса и отсутствие завышенных ожиданий от процедуры.
Но даже в сложных случаях с помощью препаратов GANA FILL удается достичь желаемого эффекта.
Полную версию статьи читайте в журнале Метаморфозы 2023/41
Особое место среди стимуляторов неоколлагеногенеза занимает полимолочная кислота (PLA). PLA широко используют с тех пор, как она была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в качестве инъекционного средства для увеличения объема мягких тканей лица при лечении липоатрофии из-за ее значительной терапевтической эффективности.
Ожидается, что спрос на новые биоматериалы, дающие хорошие клинические результаты там, где требуется восстановление объема тканей, будет продолжать расти. В связи с этим исследователи всего мира предпринимают усилия к разработке новых, еще более эффективных дермальных наполнителей на основе PLA. Ниже будет представлен один из таких препаратов нового поколения.
КОЛЛАГЕН И СТАРЕНИЕ
Хронологическое старение кожи – сложный процесс, который контролируется многочисленными внутренними и внешними факторами; один из важнейших среди них – постепенная деградация сети коллагеновых волокон дермы. Внеклеточный матрикс (ВКМ) состоит в основном из волокон коллагена I и III типов, образующих каркас, в котором фибробласты, продуцирующие матрикс, закрепляются посредством трансмембранного связывания с рецептором интегрина. Это растягивает фибробласты, обеспечивая целостность клеток и сбалансированную выработку коллагена и разрушающих матрикс металлопротеиназ (ММП). Помимо ММП, фибробласты также могут высвобождать тканевые ингибиторы матриксных металлопротеиназ (ТИММП).
В стареющей коже коллагеновые волокна фраг ментируются, а фибробласты теряют устойчивость и разрушаются [1]. В поврежденном матриксе дермы фибробласты контактируют только с небольшим числом коллагеновых волокон или с фрагментами коллагена; это ведет к изменению их пространственной структуры. В отсутствие напряжения и растяжения фибробласты перестают синтезировать коллаген и переключаются на продукцию матриксных металлопротеиназ, что приводит к еще большей деградации матрикса. Формируется порочный круг, при котором запущенные внутренние механизмы старения кожи поддерживаются неблагоприятными внешними факторами.
Снижение выработки коллагена и увеличение выработки ММП приводят к дряблости кожи. Таким образом, причина ведущих проявлений старения кожи – прогрессирующее снижение содержания основных структурных элементов внеклеточного матрикса (коллагена, эластина, гликозаминогликанов) и изменение их характеристик.
Несмотря на различия в образе жизни и окружа ющей среде, первые признаки старения лица человека проявляются в возрасте 20–30 лет. Сетевая архитектура дермы играет ведущую роль в определении механического поведения всей кожи, при этом наибольшее сопротивление растяжению и птозу оказывает кожа с высокой плотностью несущего нагрузку внеклеточного матрикса (в основном коллагена).
С наступлением менопаузы содержание коллагена в коже с каждым годом неуклонно снижается. В первые 5 лет теряется до 30% коллагена кожи [3]. Это обусловливает потерю эластичности и плотности кожи, уменьшение ее толщины, формирование морщин.
МЕТОДЫ АКТИВАЦИИ СИНТЕЗА КОЛЛАГЕНА В КОЖЕ
Поскольку потеря коллагена – наиболее драматич- ный и значимый фактор появления внешних при- знаков старения кожи, подавляющее большинство омолаживающих методов косметологического воз- действия направлено именно на активацию синте- за и улучшение качества этого структурного белка дермы. Все эти методы активации синтеза коллагена могут быть сгруппированы в пять основных блоков.
- Контролируемая травма. Повреждение кожи химическими (различные пилинги), физическими (лазерами, PF-методами) или механическими (дермароллерами) факторами при условии контроля обширности, выраженности и глубины повреждения запускает процессы последующей репарации с активацией синтеза коллагена.
- Фото- и термическая стимуляция. Эти методы отличаются от предыдущих тем, что не вызывают разрушения ткани, т.е. являются более щадящими. К ним относят неаблятивные лазеры и RF-технологии, ИФ-излучение, HIFUS, IPL.
- Биологическая стимуляция. Это возможность активировать синтетическую функцию фибробластов путем введения в организм различных сигнальных молекул. Такими молекулами могут выступать анаболические гормоны, ретинол, коллаген, матрикины, факторы роста, пептиды, компоненты плацентарных препаратов, PRP. Способы введения могут быть различными – от перорального приема в составе БАД и лекарственных препаратов до накожного нанесения и инъекций.
- Механическая стимуляция. Изменение натяжения мембран фибробластов – также важный фактор стимуляции их синтетической функции. Поэтому введение объемных наполнителей (филлеров) и нитей приводит к активации перифокально расположенных фибробластов и отложению коллагена вокруг имплантата.
- Химическая стимуляция. Ряд химических соединений оказывает выраженное стимулирующее действие на фибробласты, причем длительность эффекта напрямую будет зависеть от скорости деградации препарата. Таким образом работают полимолочная кислота, гидроксиапатит кальция и поликапролактон. В определенной степени к этому виду стимуляции можно отнести и действие органических кислот в невысокой концентрации, хотя такой эффект довольно слаб и непродолжителен.
Возрастные изменения кожи – многогранный процесс, затрагивающий клеточную деградацию. Также не стоит исключать и действие внешних факторов, в частности, УФО, приводящих как к повреждению генетического аппарата клеток, так и к процессу денатурации белковых структур.
Все это приводит к тому, что запускается процесс аномальной сборки неполноценных коллагеновых фибрилл, изменяющий межклеточный матрикс дермы. Нарушение баланса происходит не только в сборке коллагена, но и на уровне ферментов, отвечающих за синтез и разрушение структурных компонентов дермы. Визуально это проявляется в дряблости, атоничности, снижении эластичности, изменении цвета кожи и т.д.
На сегодняшний день ремоделирование коллагенового матрикса дермы – одна из важнейших задач в сфере эстетической медицины. Существует большое количество методик, аппаратных и инъекционных, направленных не только на неоколлагеногенез, но и на неофибрилогенез. Из инъекционных методов в практике врача-косметолога наиболее значимое место заняли инъекции PLA.
Инъекции PLA имеют продолжительную историю применения с высоким профилем безопасности. Необходимо отметить, что поддержание профиля безопасности для инъекции PLA требует соблюдения техники ее инъецирования с учётом уникальных характеристик отдельного препарата. Что по оценке в ретроспективе свидетельствует о благоприятном соотношении риска и пользы.